En los planes de erradicación de la salmonela que se llevan a cabo en España y toda la Unión Europea en la avicultura de puesta y la de carne, la vacunación de los reproductores es una de las armas más eficaces con las que se cuenta. En esta presentación se exponen los objetivos y la técnica de esta vacunación, con las ventajas consiguientes para la salud del pollo.
La relevancia de Salmonella spp no se debe a su papel como patógeno, aunque algunas serovariedades pueden causar clínica en aves, sino a su impacto en la salud pública, debido a que es una de las zoonosis más frecuente en los diferentes países de la UE y en otros países del mundo. Las aves, son importantes reservorios de Salmonella spp para los humanos.
El control de la salmonelosis se ha hecho un imperativo legal desde la aprobación de diferentes directivas relacionadas con diversas zoonosis (2002/99/CE y 2003/99/CE) y de su transposición en el ámbito nacional (RD 1976/2004 y RD 1940/2004). Por ello, los diferentes agentes implicados en la producción, manipulación y distribución de animales y de productos de origen animal han de implicarse directamente en el seguimiento, control y, en la medida de lo posible, erradicación de las diferentes zoonosis que pudieran estar implicadas en toxiinfecciones alimentarias.
La presencia de Salmonella spp en las granjas avícolas supone un problema para el comercio de carne de pollo y ovoproductos en Europa.
Hasta hace pocos años la mayoría de infecciones humanas tenían su origen en aves, o en productos aviares, y la mayor proporción de casos positivos de salmonelosis en animales se detectaban en granjas avícolas. Sin embargo, en los últimos años han aumentado los aislamientos de Salmonella spp a partir de otras especies destinadas al abastecimiento de carne de consumo, especialmente en porcino.
La ruta principal de entrada de Salmonella en el organismo es la ruta oral, por ingestión de alimentos contaminados o por contacto directo con un portador.
Desde este punto, los microorganismos tienen acceso al tracto gastro-intestinal, y, una vez allí, invaden los enterocitos y las células M (células de la mucosa intestinal), proliferando dentro de los fagosomas del epitelio intestinal y en las células linfoides (Placas de Peyer). Las infecciones entéricas pueden, en algunos casos, generalizarse por paso de las salmonelas a los vasos linfáticos abdominales y, de allí, al torrente circulatorio, produciéndose la diseminación del microorganismo a diversos órganos internos: linfonodos mesentéricos, bazo, hígado, pulmón, articulaciones, sistema reproductor…
Genéticamente, se han definido dos especies dentro del género Salmonella: Salmonella enterica (LeMinor y Popoff, 1987) y Salmonella bongori (Reeves et al., 1989). Bioquímicamente, pueden diferenciarse claramente las dos especies de Salmonella, y, además, se han definido seis subespecies diferentes dentro de la especie Salmonella enterica: I enterica, II salamae, IIIa arizonae, IIIb diarizonae, IV houtenae y VI indica. Dentro del género Salmonella se incluyen dos especies, seis subespecies y 2324 serovariedades. La lista completa de todas las fórmulas antigénicas de las diferentes serovariedades del género Salmonella, está recopilada en el Esquema de Kauffmann y White.
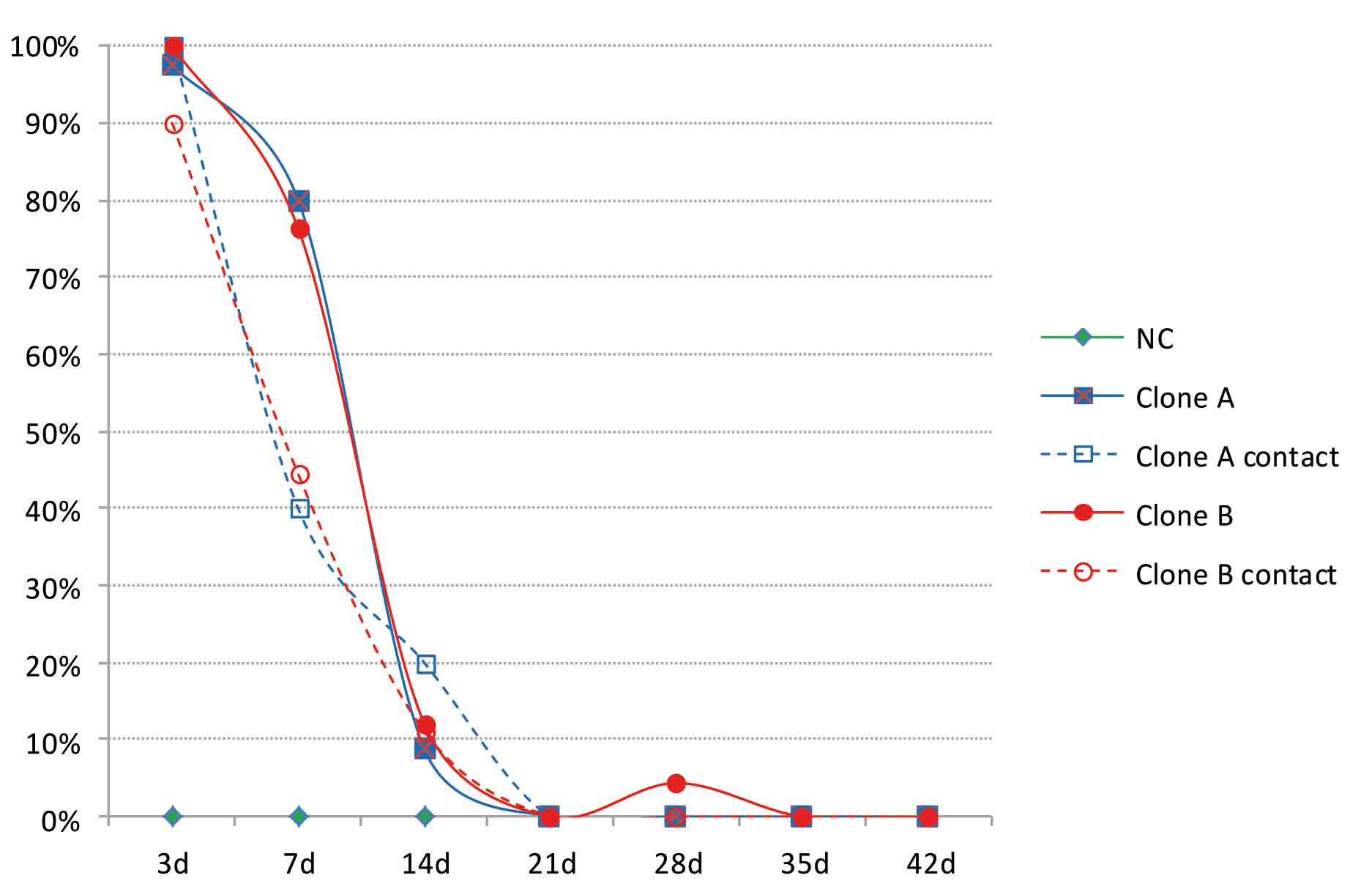
Figura 1. Porcentaje de hisopos cloacales positivos a Salmonella por PRC en animales vacunados a día de vida o en contacto con animales vacunados.
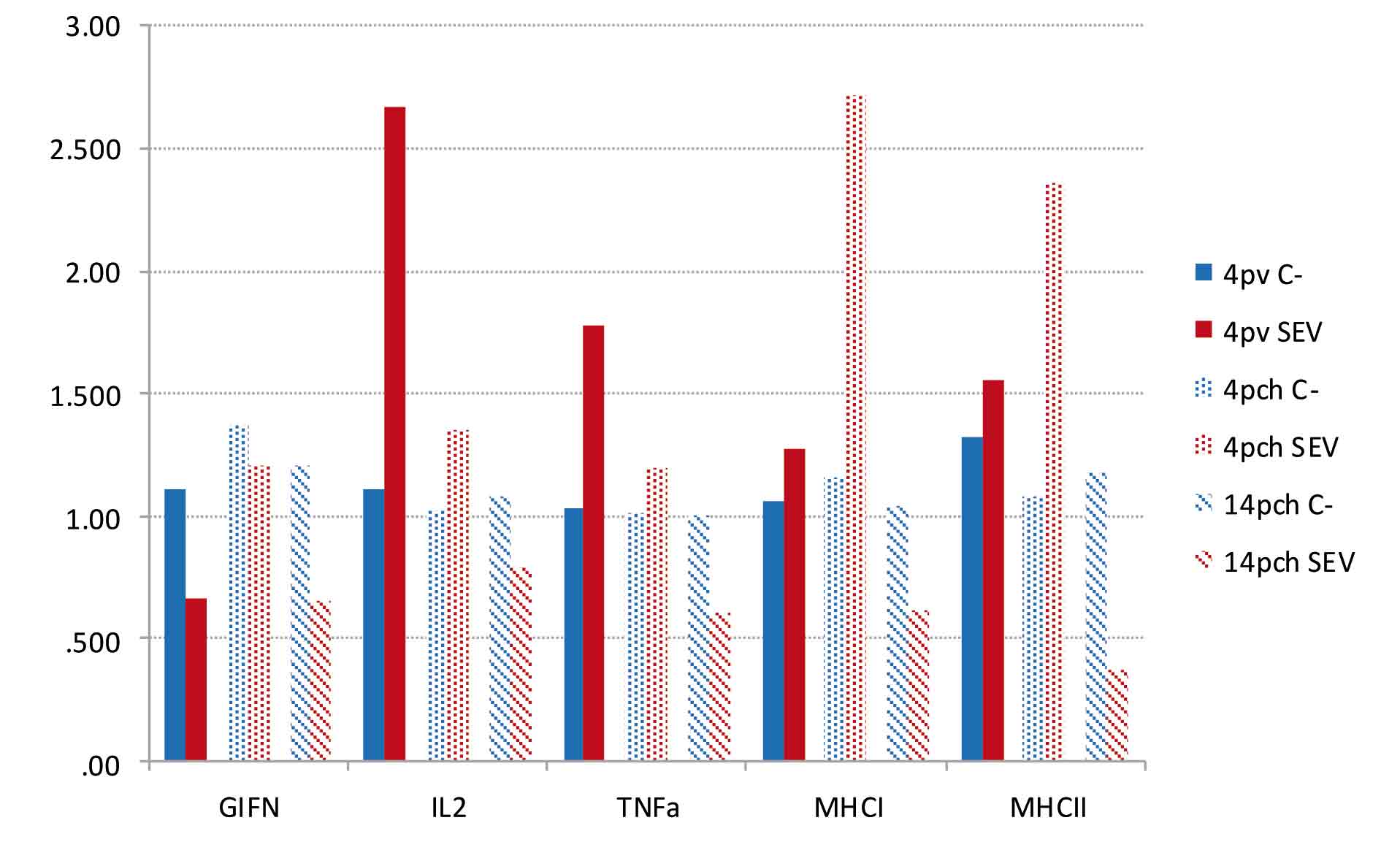
Figura 2. Estudio de marcadores de respuesta inmune de mucosa intestinal en animales vacunados con Salmonella Enteritidis. (GIFN: Gamma Interferón, IL2: Interleuquina 2, TNFa: Factor de inducción del Factor de Necrosis Tumoral alfa, MHC I: Complejo Mayor de Histocompatibilidad tipo I, MHC II: Complejo Mayor de Histocompatibilidad tipo II.
A modo de ejemplo, las fórmulas antigénicas para las serovariedades Enteritidis y Typhimurium son las siguientes: ser Enteritidis 1,9,12:g,m:- y ser Typhimurium 1,4,[5],12:i:1,2. Si analizamos ambas fórmulas antigénicas, podemos ver la escasa relación entre estas dos serovariedades de Salmonella enterica.
La forma más positiva de enfocar el control de un problema infeccioso, con las características de la salmonelosis en granjas de producción, debe aproximarse al enfoque que tienen otras industrias productivas, el análisis y control de puntos críticos. Este enfoque permite conocer cuál es el papel que juega cada uno de los diferentes puntos de la cadena de producción en la transmisión o mantenimiento del agente infeccioso, y que medidas -de eliminación o de prevención- han de utilizarse en cada punto para minimizar riesgos. El análisis de los diferentes factores, el enfoque epidemiológico de los resultados (análisis del grado de relación de los diferentes aislados), y una orientación multidisciplinaria de la investigación pueden constituir puntos favorables para encontrar soluciones compatibles con las exigencias de los consumidores al mismo tiempo que con las exigencias de los productores.
El aislamiento de Salmonella spp. por el método normalizado (método ISO), o alguna de sus variantes, es suficientemente largo y laborioso como para hacer deseable un método preliminar que permita la eliminación de las muestras que vayan a dar, muy probablemente, un resultado negativo. En algunos países europeos, especialmente en Dinamarca (Baggessen et al., 1996), se han utilizando métodos serológicos para realizar el seguimiento del estado actual de la salmonelosis en una determinada explotación, utilizándose estos métodos para discriminar entre granjas porcinas positivas y negativas. No obstante, la serología tiene una marcada falta de correlación con el aislamiento de Salmonella para un determinada muestra/animal.
Como ayuda para el seguimiento y control de la salmonelosis en las granjas de producción, la detección de secuencias génicas específicas, aunque cabe la posibilidad de detección de microorganismos no viables, pueden ayudar a realizar el cribado preliminar de las muestras analizadas y centrar los esfuerzos, de los métodos microbiológicos clásicos, en las muestras en las que se obtengan amplificaciones de fragmentos de DNA bacteriano, de tamaños bien definidos, por la utilización de “primers” específicos y PCR. En el caso de Salmonella, las secuencias más útiles para este propósito son las de los genes invA, iroB, spvC, sefA o de la secuencia de inserción IS200.
La expresión de antígenos bacterianos in vitro y su uso como vacunas es una estrategia ampliamente utilizada para la prevención de agentes infecciosos. No obstante, este tipo de vacunas presentan serias deficiencias ya que, los antígenos expresados in vitro, no siempre se corresponden con los antígenos que expresan los patógenos en el interior del animal. Este hecho es de extraordinaria importancia cuando los anticuerpos neutralizantes se producen exclusivamente contra antígenos expresados in vivo o en condiciones muy especiales de crecimiento in vitro.
Entre los diferentes antígenos que un patógeno puede expresar in vivo, pero no en las condiciones habituales de crecimiento in vitro, se encuentran las proteínas implicadas en la captación de hierro (Finley y Falkow, 1997). Este elemento es esencial para el crecimiento y desarrollo de prácticamente todos los seres vivos. En los organismos superiores, el hierro en estado libre se halla en concentraciones extremadamente bajas, ya que se encuentra asociado a moléculas, generalmente proteínas, con alta afinidad por él, como por ejemplo la hemoglobina, la transferrina, la lactoferrina o la ovoalbúmina (Payne, 1993). Por esta razón, los microorganismos patógenos emplean diferentes estrategias destinadas a captar la cantidad suficiente de hierro para cubrir sus necesidades (Weinberg, 1995).
Una de las estrategias para obtener hierro, por parte de las células bacterianas, consiste en la síntesis y excreción de pequeñas moléculas, conocidas con el nombre de sideróforos, que captan el hierro del medio y facilitan su introducción al interior de la bacteria, tras interaccionar con receptores específicos que se encuentran en la membrana externa (Earhart, 1996). Este sistema lo presentan fundamentalmente las enterobacterias, Salmonella spp incluida, siendo conocido desde hace años el potencial inmunogénico de las proteínas de membrana receptoras de los sideróforos (Chart y Griffiths, 1985; Griffiths et al., 1985; Boiln y Jensen 1987; Fernandez-Beros et al., 1989). Este hecho ha llevado a sugerir que estas proteínas receptoras de sideróforos pueden ser excelentes inmunógenos (Kingsley et al., 1995).
Por lo anterior puede deducirse que, la utilización de cepas vivas atenuadas de Salmonella entérica, puede inducir mayor protección de los animales que la utilización de vacunas inactivadas crecidas del modo convencional.
Nuestro grupo ha analizado diferentes aspectos, tanto de seguridad como de eficacia, de una cepa viva atenuada (Primum Salmonella E) para el control de Salmonella Enteritidis en ponedoras.
En uno de los primeros estudios, analizamos la persistencia de la cepa vacunal en animales. En este estudio pudimos comprobar que, tres días después de la vacunación, el 99% de los animales vacunados, así como el 94% de los animales no vacunados en contacto con los primeros, fueron positivos a la cepa vacunal. Este porcentaje de positivos se fue reduciendo paulatinamente, en ambos tipos de animales, hasta negativizarse a los 21 días después de la vacunación (Figura 1). El análisis de IgA secretoria presente en la bilis de los animales, a los 28 días post-vacunación, reveló el aumento significativo de anticuerpos anti Salmonella Enteritidis, mediante la técnica de ELISA, en los animales que habían estado en contacto con la cepa viva atenuada de Salmonella Enteritidis (vacunados o en contacto).
Además de la respuesta de anticuerpos, examinamos el grado de expresión de algunos genes relacionados con la respuesta inmunitaria de la mucosa intestinal. Para este estudio se analizó, por PCR-cuantitativa, el grado de expresión relativa de IFN-γ, IL-‑2, TNF-alfa (factor de inducción de TNF-alfa) y de los complejos de histocompatibilidad tipo I (MHC I) y tipo II (MHC II). En la Figura 2 pueden verse los resultados obtenidos, de los que puede inferirse la estimulación de la expresión de IL-2 y TNF-alfa a los 4 días de la vacunación (Figura 2, 4pv). Además, tras 4 días del enfrentamiento con una cepa de campo de Salmonella Enteritidis, se observaría un aumento de expresión de los genes MHC I y MHC II que pueden asociarse con un aumento de células presentadoras de antígenos (macrófagos y células dendríticas) en los animales vacunados frente a los animales no vacunados (Figura 2, 4pch). Catorce días después del enfrentamiento con la cepa de campo de Salmonella Enteritidis, los animales vacunados mostraron una menor estimulación de los genes IFN-γ, IL-‑2, TNF-alfa, MHC I y MHC II que los animales no vacunados, disminución que puede representar un aclaramiento más rápido de la cepa de enfrentamiento en los animales vacunados (Figura 2, 14pch).
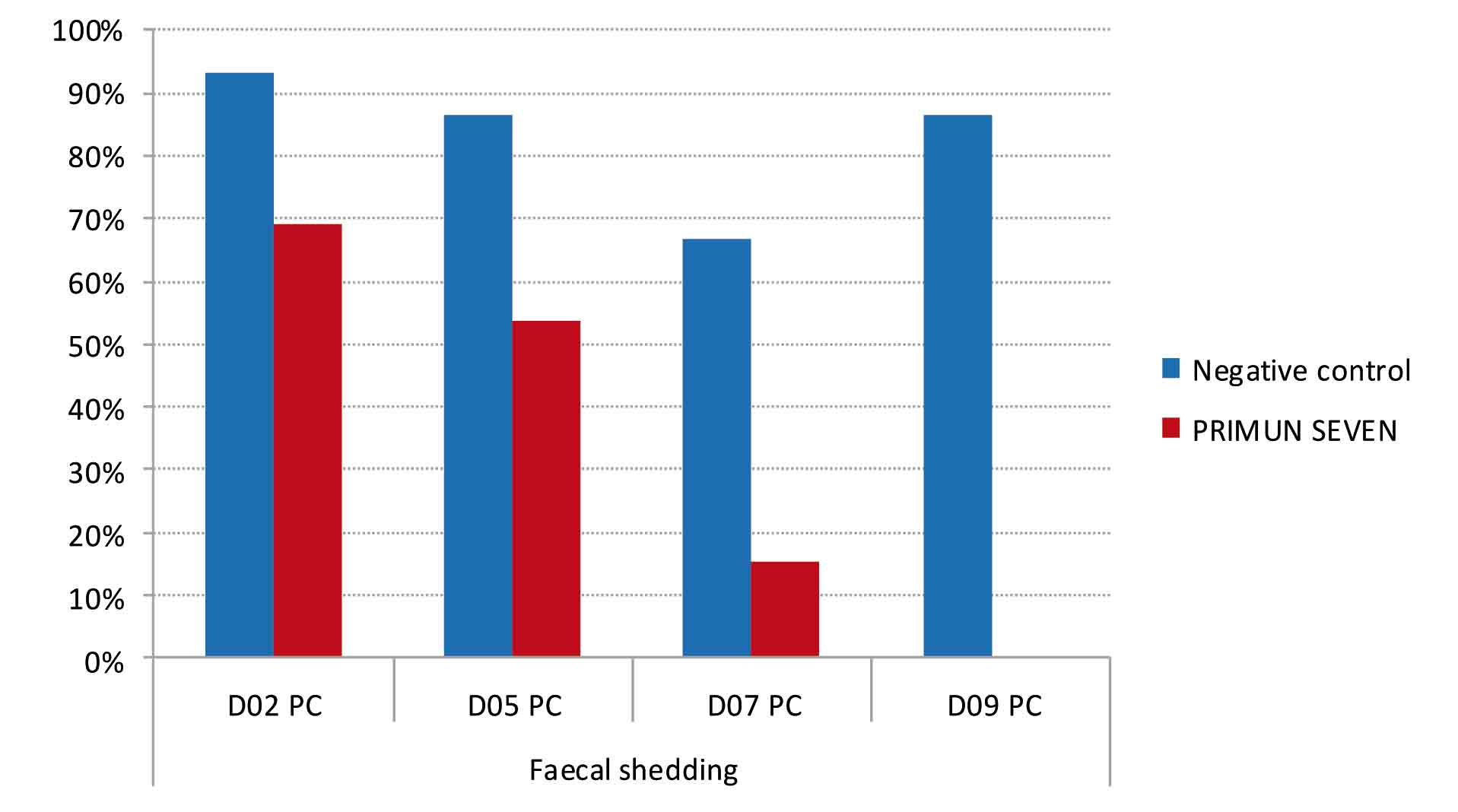
Figura 3. Efecto de la inmunización con una cepa viva atenuada sobre la excreción fecal de Salmonella Enteritidis en ponedoras enfrentadas a una cepa de campo de Salmonella Enteritidis (Final del periodo de inmunización, 3ª dosis).
Este mayor aclaramiento de la cepa de campo, utilizada para el enfrentamiento de los animales, puede verse en la Figura 3. En esta gráfica se puede ver que la cepa de Salmonella Enteritidis, utilizada para la infección experimental de los animales, se fue eliminando progresivamente, hasta dejarse de detectar a los 9 días, en los animales vacunados; mientras que en los animales no vacunados, esa disminución progresiva no se observó, manteniéndose positivos el 87% de los animales a los 9 días de la infección.
De estos, y otros estudios realizados, podemos inferir el efecto positivo de la inmunización, de las futuras productoras o reproductoras, con cepas vivas atenuadas de Salmonella Enteritidis.
Ignacio Badiola Sáiz, Judith González, Nuria Aloy y Ana María Pérez de Rozas. IRTA-Centre de Recerca en Sanitat Animal. [email protected] Ignacio Badiola ha realizado numerosos trabajos sobre el uso de antimicrobianos o resistencias microbianas, entre otros. Fue miembro del comité científico de nutrición animal de la UE durante los años 2000 y 2001 y miembro del grupo asesor sobre antimicrobianos de la European Agency for the Evaluation of Medicinal Products (2004-2009). Ha sido profesor de la National Autonomous University of Mexico (2004) y presidente de la Asociación Española de Cunicultura (ASESCU) hasta el año 2012 y vicepresidente de la World Rabbit Science Association. Ha sido experto en salud animal para el INIA y miembro del plan estratégico español para la reducción del riesgo de resistencias a los antibióticos, responsabilidad con la que continúa en la actualidad. [wbcr_php_snippet id="90268"]