Los principales factores predisponentes para la enteritis necrótica en pollos de engorde y el uso de probióticos como nueva estrategia para prevenir la enfermedad
Resumen
La enteritis necrótica causada por la bacteria patógena Clostridium perfringens es la enfermedad bacteriana más común y económicamente devastadora en la industria avícola. Numerosos factores pueden favorecer la colonización y proliferación de C. perfringens, amenazando la salud de las aves. Estos factores predisponentes incluyen la alteración de la microbiota intestinal, daño severo de las superficies epiteliales y la alteración del estado inmunológico de los animales. Por tanto, surge la necesidad de un uso profiláctico de probióticos para prevenir o mitigar la enfermedad. La exclusión competitiva que ejercen las bacterias probióticas de los géneros Bacillus, Lactobacillus, Bifidobacterium y Enterococcus, puede obstaculizar la proliferación del patógeno, prometiendo ser una solución eficiente y eficaz para reemplazar el uso de antibióticos en la industria avícola, promoviendo la salud animal y favoreciendo su productividad.
Introducción
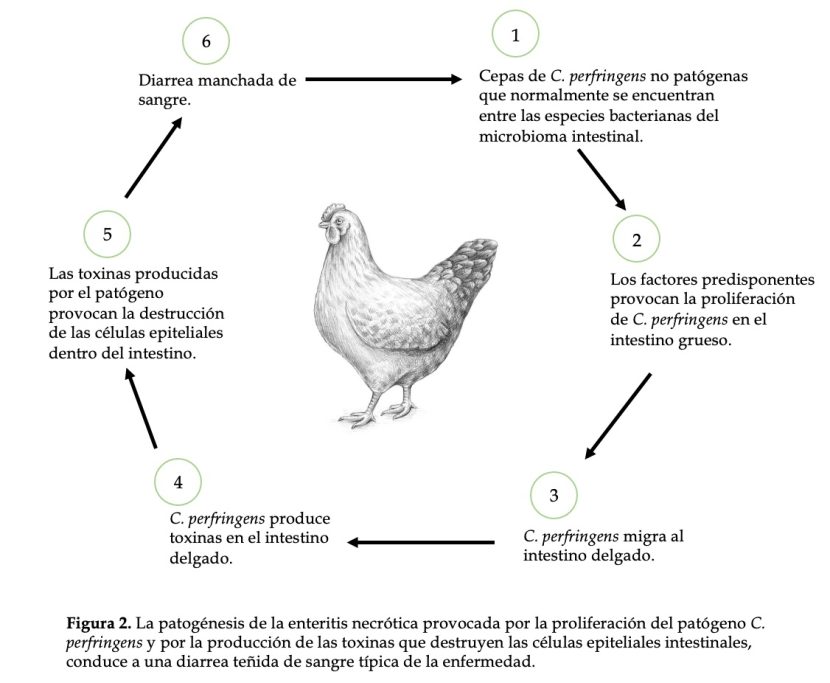
La enteritis necrótica (EN) es una de las enfermedades más comunes y, al mismo tiempo, más devastadoras desde el punto de vista económico de las manadas de pollos de engorde. Es una enfermedad bacteriana multifactorial que le cuesta a la industria avícola hasta US $ 6 mil millones por año en medidas de control y pérdidas de productividad [1]. La EN es una enfermedad infecciosa causada por la especie Clostridium perfringens, una bacteria Gram positiva anaeróbica que se encuentra en el suelo, en los residuos, en el polvo y, en bajos niveles, en el intestino sano de las aves. C. perfringens causa la enfermedad cuando se convierte de no productor a productor de toxinas; de hecho, la EN es causada por la especie que sintetiza la toxina NetB, responsable de la formación de lesiones necróticas en el intestino [2]. Aunque se ha confirmado que las cepas de C. perfringens que producen la toxina NetB son la causa última de la EN en pollos, parece que una simple infección no es suficiente para desencadenar la enfermedad. Los factores predisponentes o de riesgo son necesarios para crear un ambiente favorable para la proliferación del patógeno [3; 4].
La forma clínica clásica de la enteritis necrótica se caracteriza por un aumento repentino de la mortalidad de las aves de producción, hasta un 50%, a menudo sin ningún signo visible o de advertencia, aunque la cama húmeda puede ser un indicador de la enfermedad. La forma subclínica de la infección es la más frecuente: no hay signos clínicos de la enfermedad y, por lo general, ni siquiera un pico de mortalidad. Las lesiones crónicas de la mucosa causan una pérdida de productividad debido a una digestión y absorción deficientes, una pérdida de peso significativa y un aumento en el índice de conversión [5; 6]. El daño intestinal causado por una infección subclínica puede permitir que las bacterias lleguen al tracto biliar y a la circulación portal hepática, colonizando finalmente el hígado y causando colangiohepatitis [7]. Si bien la manifestación clínica de la EN puede ocasionar altos índices de mortalidad, la forma subclínica es la más importante y nociva ya que puede persistir en la manada sin ningún tipo de manifestación. Sin síntomas, los pollos no son tratados y, como resultado, la necrosis subclínica ocasiona grandes pérdidas económicas a la industria avícola [8].
La enfermedad causa lesiones macroscópicas principalmente en el intestino delgado y con menos frecuencia en otros órganos, como los riñones y el hígado. Después de la necropsia, el duodeno, el yeyuno y el íleon parecen tener paredes más delgadas de lo normal y llenas de gas. La enteritis necrótica clínica causa necrosis de grandes porciones del intestino delgado, cubiertas por pseudo-membranas de color marrón amarillento o teñidas de bilis. La EN subclínica, en cambio, presenta úlceras en la superficie de la mucosa, con material descolorido e indefinido que se adhiere a ella [9; 10]. Además, el análisis microscópico de los estadios tardíos de la EN muestra una necrosis coagulativa severa de la mucosa, principalmente de los enterocitos de las vellosidades intestinales [6].
Junto con Campylobacter y Salmonella, C. perfringens es uno de los patógenos bacterianos aislados con mayor frecuencia en los brotes de enfermedades transmitidas por alimentos en humanos. Esto confirma que la infección por C. perfringens en las aves de corral presenta un alto riesgo de transmisión a través de la cadena alimentaria [11]. El uso de probióticos podría ser una alternativa válida para evitar que el microbiota de los pollos sea colonizado por el patógeno. Stanley y col. [12] demostraron con un modelo de inducción de enteritis necrótica mediante su exposición a C. perfringens, que las aves que desarrollaron la enfermedad experimentaron cambios significativos en su microbiota en comparación con las que permanecieron sanas. En este estudio, el grupo de animales a los que se les administró un probiótico, específicamente Bacillus licheniformis H2, y que posteriormente fueron infectados para inducir la enfermedad, desarrollaron síntomas menos severos y un menor cambio en la composición de la microbiota que las aves no tratadas con el probiótico. Este resultado confirmó el vínculo entre la composición de la microbiota y los síntomas de la enfermedad [13].
Factores predisponentes para el desarrollo de EN en pollos
Los factores predisponentes para la enteritis necrótica en las aves domésticas se dividen en cuatro grupos principales (Figura 1): i) cambios en el intestino, ii) cambios en el estado inmunológico de las aves, iii) alteración de la microbiota del tracto gastrointestinal (TGI), iv) proliferación del patógeno C. perfringens [4; 6; 13].
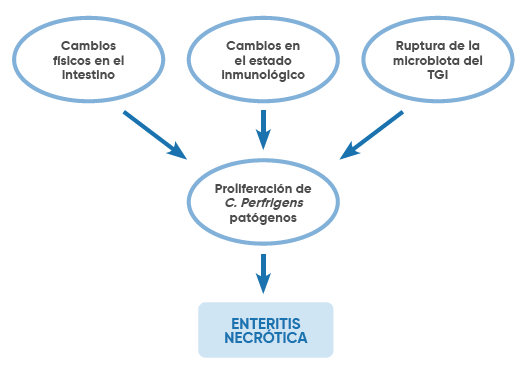
Figura 1. Los cuatro factores principales para el desarrollo de enteritis necrótica en pollos.
Cambios en el intestino. La primera precaución que se debe tomar para prevenir la infección por C. perfringens es evitar crear un entorno favorable para la proliferación de patógenos. La dieta se convierte así en un importante factor de control que puede influir en la aparición y la incidencia de la EN. Los componentes específicos del pienso pueden alterar las propiedades físicas de la digestión, promover el crecimiento de C. perfringens e incluso cambiar la composición de la microbiota TGI [4; 6]. Una dieta rica en polisacáridos no amiláceos y poco digeribles es un factor de riesgo importante que predispone a los animales a la aparición de la EN ya que, además de tener un tiempo de tránsito intestinal prolongado, aumentan la viscosidad del intestino, creando un ambiente favorable para la proliferación de C. perfringens. Por lo tanto, el trigo, la avena, el centeno y la cebada no se recomiendan para la nutrición de las aves domésticas, ya que las alimentadas con estos granos tienen más probabilidades de sufrir EN que las alimentadas con maíz [14]. Como se mencionó anteriormente, la cama húmeda es un signo de una posible infección por C. perfringens: las dietas ricas en polisacáridos no amiláceos conducen a una mayor ingestión de agua, lo que origina una cama húmeda, que, en consecuencia, puede crear un ambiente favorable para la esporulación contaminante de las bacterias patógenas [4; 14].
La infección por coccidiosis es el factor predisponente más conocido de la EN. Se ha demostrado que C. perfringens y Eimeria spp. actúan sinérgicamente para inducir lesiones típicas de la enteritis necrótica [15; 16]. Los parásitos de Eimeria colonizan el intestino delgado y matan las células epiteliales. El daño físico provocado por la infección compromete la integridad epitelial del TGI, y esto podría conllevar graves consecuencias como la apertura de un acceso directo a la capa basal intestinal, la exposición de las moléculas de la matriz extracelular, como el colágeno, facilitando la adhesión de C. perfringens, así como la sobreproducción de moco que proporcionaría otra fuente de nutrientes ricos en proteínas para la proliferación de patógenos [4].
También se ha descubierto que una alta concentración dietética de proteínas animales, como la harina de pescado, es un factor de riesgo para el desarrollo de la EN. C. perfringens carece de muchos genes necesarios para la biosíntesis de aminoácidos, por lo que las bacterias no pueden crecer en un entorno donde el suministro de aminoácidos es limitado. Estas dietas contienen proteínas poco digeribles que permanecen en alta concentración en el TGI, induciendo el crecimiento de C. perfringens y el consiguiente cambio de composición de la microbiota; estos efectos están modulados por el aumento de nutrientes y probablemente también por el aumento del pH en todo el tracto gastrointestinal [17; 4]. Knarreborg y col. [18] encontraron que la grasa animal en las dietas, en comparación con la grasa vegetal, también puede tener efectos sobre la población de C. perfringens.
Finalmente, también la forma física del pienso puede influir en la incidencia de la EN: un tamaño uniforme del mismo reduce el riesgo de aparición de enfermedades en comparación con el alimento que contiene partículas de tamaño heterogéneo [19].
Cambios en el estado inmunológico. El momento de mayor riesgo para que las aves domésticas contraigan la EN es alrededor de las tres semanas de edad, cuando los anticuerpos maternos comienzan a desaparecer del torrente sanguíneo del pollo. Estos cambios importantes en el estado inmunológico provocan una mayor susceptibilidad a la infección y proliferación por C. perfringens [20].
 Cualquier tipo de estrés puede considerarse como un factor de riesgo potencial que puede predisponer al animal a la aparición de la EN. El hacinamiento, el amoníaco ambiental y el estrés fisiológico pueden disminuir las defensas inmunológicas del pollo, exponiendo al animal a una posible infección causada por el patógeno. Por este motivo, se recomienda una densidad de población no demasiado elevada, ya que podría ser un factor predisponente para la contaminación [21]. Además, la exposición a agentes inmunosupresores, como los virus que causan la enfermedad de Marek, la enfermedad de Gumboro o la anemia de los pollitos, reduce la resistencia de los animales a las infecciones del TGI, aumentando la gravedad de la EN [22].
Cualquier tipo de estrés puede considerarse como un factor de riesgo potencial que puede predisponer al animal a la aparición de la EN. El hacinamiento, el amoníaco ambiental y el estrés fisiológico pueden disminuir las defensas inmunológicas del pollo, exponiendo al animal a una posible infección causada por el patógeno. Por este motivo, se recomienda una densidad de población no demasiado elevada, ya que podría ser un factor predisponente para la contaminación [21]. Además, la exposición a agentes inmunosupresores, como los virus que causan la enfermedad de Marek, la enfermedad de Gumboro o la anemia de los pollitos, reduce la resistencia de los animales a las infecciones del TGI, aumentando la gravedad de la EN [22].
Ruptura de la microbiota del TGI. Las recientes investigaciones en virología han constatado que no existen niveles bajos de la población de C. perfringens dentro del TGI de los pollos que bajo ciertas circunstancias predisponentes proliferan para producir la enfermedad, como se creía anteriormente, sino estas mismas cepas, que circulan a niveles bajos en aves sanas, son en realidad líneas no patógenas de la misma especie. Las cepas patógenas parecen infiltrarse y proliferar en un ambiente favorable a expensas de las no patógenas para dominar la población de C. perfringens y así inducir la enfermedad en las aves [23; 4]. Moore y col. [5] explican que los grupos de aves expuestos al patógeno y que desarrollan la EN tienen diferencias significativas en su microbiota intestinal en comparación con las sanas. Esto subraya una relación causal entre la microbiota y la colonización de C. perfringens, aunque no está claro si es la proliferación del patógeno la que induce cambios en la flora bacteriana o si es un determinado tipo de microbiota la que es más susceptible a infecciones y, en consecuencia, al desarrollo de la enfermedad [4].
Muchos de los factores que alteran el estado físico del sistema gastrointestinal y el estado inmunológico del animal también afectan la composición de la microbiota. Recientemente se ha demostrado que la alimentación de animales con dietas contaminadas por micotoxinas de Fusarium, desoxinivalenol y fumonisinas (FB), podría ser otro factor predisponente para la aparición de la enteritis necrótica [24]. Parece que, además de la coccidiosis, los piensos contaminados con FB también provocan una reducción en la abundancia de la bacteria filamentosa segmentada (SFB) Candidatus savagella, que pertenece a un grupo único de bacterias comensales dentro de la familia Lachnospiraceae. Particularmente presentes en la mucosa ileal de los pollos, los SFB juegan un papel importante en la modulación del sistema inmunológico del huésped, especialmente en el período de transición más crítico de la inmunidad materna e innata a la inmunidad endógena y adaptativa. Es precisamente en esta ventana de tiempo crítica donde los pollos tienen más probabilidades de contraer la EN, lo que sugiere la importancia de una mayor investigación sobre el papel que pueden desempeñar los SFB en la prevención o modulación de la enfermedad [24].
Lactobacillus es uno de los géneros predominantes en el sistema gastrointestinal aviar. Estas bacterias son importantes por el papel que desempeñan en la inducción de la inmunomodulación y por la protección que ofrecen con sus actividades antagonistas frente a patógenos. Se ha demostrado que la administración de dietas a base de harina de pescado o dietas contaminadas con FB induce cambios en la composición de las especies de lactobacilos dentro del ciego de los pollos, sin cambiar el recuento total. En particular, Lactobacillus johnsonii y Lactobacillus acidophilus sufren una drástica disminución, mientras que aumenta la abundancia de Lactobacillus reuteri y Lactobacillus animalis. Se observaron los mismos cambios en pollos de engorde expuestos a la cepa patógena C. perfringens. Algunos lactobacilos, como L. johnsonii, son de gran importancia por sus actividades probióticas, incluida la inhibición de patógenos [25]. Estas especies fermentan los carbohidratos introducidos a través de la dieta en ácido láctico como principal producto final, lo que reduce el pH intestinal y provoca la inhibición del crecimiento de bacterias sensibles al ácido [26]. Además, el papel que juegan los lactobacilos en un proceso de alimentación cruzada es fundamental: a través de la producción de lactato, promueven la actividad de las bacterias productoras de butirato.
El butirato es una molécula señal importante del TGI y también un metabolito antiinflamatorio que participa en la estabilización de la integridad intestinal, la mejora del rendimiento productivo del animal, el cambio de composición de la microbiota y la actividad metabólica de todo el sistema microbiano en el intestino. El uso de harina de pescado en la dieta animal y la administración de Eimeria han demostrado ser dos de las principales causas de la disminución de la abundancia de las poblaciones de Ruminococcaceae y Lachnospiraceae, las principales bacterias productoras de butirato en el sistema intestinal de pollos y mamíferos [27; 28]. Se ha demostrado repetidamente que el butirato reduce la incidencia de la gravedad de la enteritis necrótica cuando se administra como aditivo. Su modo de acción aún no está claro, pero al colonizar principalmente el ciego de los pollos, las bacterias productoras de butirato pueden suprimir el C. perfringens patógeno en el mismo, evitando el ascenso de la infección. Por lo tanto, la función de señalización del butirato lo convierte en un metabolito esencial para el mecanismo protector universal en todas las especies animales [24; 29].
Proliferación de cepas patógenas de C. perfringens. Las cepas de C. perfringens no patógenas se aíslan con frecuencia en pollos de engorde sanos, mientras que solo un tipo de cepa predomina en los animales afectados por la EN. Todavía no está claro si los pollos que desarrollan la enfermedad ya tienen la cepa patógena dentro de su TGI que prolifera en condiciones favorables, o si ciertos factores causan la introducción de bacterias en el organismo. Como se explicó anteriormente, muchos factores pueden causar la proliferación, pero es importante comprender cómo se produce la proliferación selectiva de C. perfringens patógenos en comparación con las cepas no patógenas [4]. Timbermont y col. [23] descubrieron que la proteína antimicrobiana perfrina, metabolizada únicamente por cepas patógenas, inhibe el crecimiento de cepas comensales de C. perfringens. Por tanto, es probable, pero aún no confirmado in vivo, que la cepa patógena pueda producir bacteriocinas que inhiban el crecimiento de cepas estrechamente relacionadas, favoreciendo así su proliferación selectiva.
Inicialmente se pensó que la toxina alfa era el principal factor de virulencia de la EN en pollos de engorde, a pesar de que tanto las cepas de tipo A patógenas como las no patógenas la producen. Otro estudio refutó esta suposición, mostrando que la toxina alfa no estaba relacionada con las lesiones causadas por la enfermedad [30]. Recientemente, se ha descubierto una nueva toxina asociada con la EN en pollos de engorde, la toxina NetB. Con un estudio in vitro, Keyburn y col. [2] demostraron que, además de formar poros en la membrana plasmática, la toxina provoca redondeo y lisis celular en la línea celular de hepatoma de pollos machos. NetB parece ser una adaptación ambiental eficiente, ya que se produce cuando la concentración de C. perfringens es alta y la disponibilidad de nutrientes es limitada. El daño que la toxina causa a las células del huésped proporciona suficientes nutrientes para que las bacterias sobrevivan [31]. El descubrimiento de que el gen netB que codifica la toxina NetB se transporta en un plásmido conjugativo sugiere la posibilidad de intercambiar el plásmido entre diferentes cepas de C. perfringens y, en consecuencia, la posible transformación de una cepa no patógena en patógena [4; 32].
Uso profiláctico de probióticos para prevenir o mitigar la EN
Existe un equilibrio inestable entre las bacterias beneficiosas y no beneficiosas en el tracto gastrointestinal normal de los pollos sanos. Cuando existe este equilibrio, las aves muestran un rendimiento óptimo, pero en condiciones de estrés, la flora beneficiosa disminuye en número, lo que permite el crecimiento de bacterias no beneficiosas. Esto puede predisponer a los animales a enfermedades frecuentes o incluso reducir los parámetros de crecimiento y la eficiencia alimentaria. Los probióticos reducen el riesgo de desarrollar la EN al mejorar la inmunidad del animal, el equilibrio de la microflora intestinal y al estimular el metabolismo del huésped. Los probióticos, además de competir con las bacterias patógenas por los nutrientes disponibles, también producen sustancias microbianas que inhiben su crecimiento y proliferación [33; 34]. La composición de la microflora del TGI de los pollos de engorde juega un papel fundamental en la prevención de la aparición de la enteritis necrótica. Como se discutió anteriormente, las bacterias productoras de butirato tienen la capacidad de inhibir la inflamación del intestino y preservar su actividad normal. Las bacterias productoras de ácido láctico, a través de un mecanismo de alimentación cruzada, promueven la colonización intestinal por bacterias productoras de butirato.
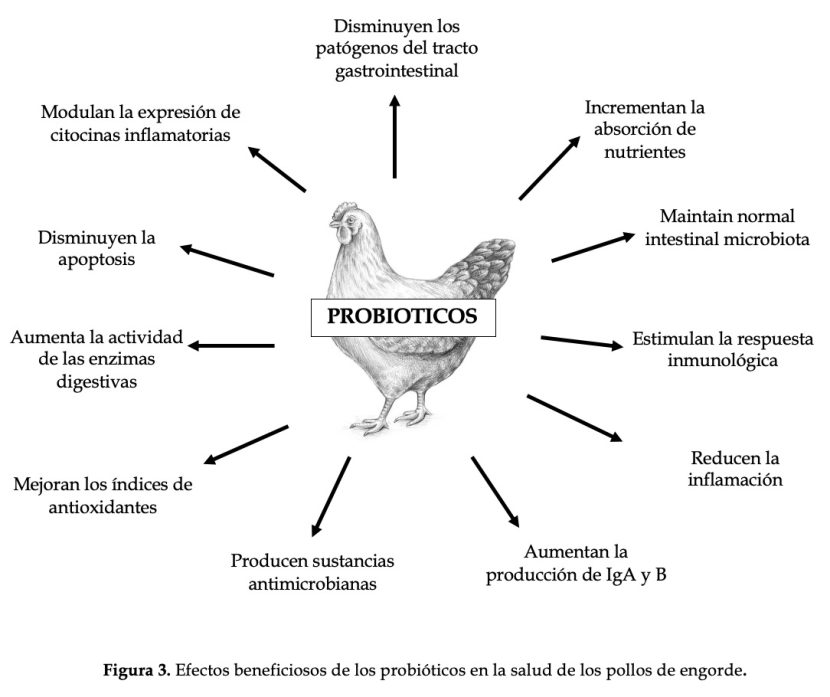
Muchos otros microorganismos han demostrado la capacidad de contrarrestar la proliferación de C. perfringens, como los géneros Bacillus, Lactobacillus, Bifidobacterium, Enterococcus y levaduras [35].
 Las especies de Bacillus promueven el crecimiento de los pollos afectados por la EN, mejorando su eficiencia alimenticia y facilitando el aumento de peso. Además de regular la síntesis de ácidos grasos y los genes relacionados con la oxidación del hígado de los pollos enfermos, este género también mejora la actividad antioxidante [36]. Bacillus spp. producen bacteriocinas que inhiben el crecimiento y la proliferación de C. perfringens, y sus esporas se utilizan en la alimentación por su capacidad para aumentar el rendimiento productivo de los pollos y reducir la mortalidad de las aves afectadas por la EN [37].
Las especies de Bacillus promueven el crecimiento de los pollos afectados por la EN, mejorando su eficiencia alimenticia y facilitando el aumento de peso. Además de regular la síntesis de ácidos grasos y los genes relacionados con la oxidación del hígado de los pollos enfermos, este género también mejora la actividad antioxidante [36]. Bacillus spp. producen bacteriocinas que inhiben el crecimiento y la proliferación de C. perfringens, y sus esporas se utilizan en la alimentación por su capacidad para aumentar el rendimiento productivo de los pollos y reducir la mortalidad de las aves afectadas por la EN [37].
Las propiedades antibacterianas de las bacterias productoras de ácido láctico permiten su uso para la prevención de la EN. Su potencial probiótico se atribuye a su capacidad para producir lactato, bacteriocinas, peróxido de hidrógeno y mejorar la inmunidad del huésped aumentando la expresión de citocinas. Hay muchas especies de Lactobacillus que pueden usarse como probióticos, y entre ellas se incluyen L. acidophilus, L. animalis, L. fermentum, L. johnsonii, L. mucosae, L. plantarum, L. reuteri y L. salivarius [35].
La capacidad de Enterococcus para producir peróxido de hidrógeno y bacteriocinas con actividad anti C. perfringens, e inhibir la producción de toxinas, los convierte en un probiótico potencialmente poderoso para la prevención de la EN. En pollos expuestos a la cepa patógena la administración de Enterococcus faecium ayuda a aliviar la pérdida de peso, la lesión intestinal, la inflamación histopatológica y previene la apoptosis de las células intestinales [35].
La importancia de una microbiota fundadora en los pollos de engorde
En las prácticas comerciales de la industria avícola, los pollitos recién nacidos están expuestos a los microbios derivados del entorno de la incubadora, los manipuladores humanos, las cajas de transporte y los vehículos de transporte, antes de llegar a la granja. Este proceso generalmente se lleva a cabo dentro de las primeras horas de vida, momento en el que se produce un rápido aumento de la diversidad y la carga bacterianas en el intestino de los pollos. Estas primeras fuentes bacterianas tienen una influencia significativa en el desarrollo de la microbiota intestinal ya que es durante estas primeras horas de vida cuando se produce la colonización más significativa del intestino de los pollos. Por lo tanto, la ausencia del entorno natural y el contacto con adultos de la misma especie hace que la comunidad fundadora del TGI de los polluelos sea particularmente susceptible a las fuentes bacterianas humanas y ambientales [38].
La colonización bacteriana inicial inhibe o promueve la invasión y estabilización de bacterias subsiguientes en el ambiente intestinal y produce metabolitos que pueden apoyar o retardar el crecimiento de otras bacterias. Por tanto, los primeros días tras la eclosión son fundamentales para la colonización eficaz por bacterias beneficiosas y la exclusión selectiva de las patógenas [4]. El tipo de dieta que consumen los pollos tiene un impacto importante en la composición de su microbiota intestinal, ya que proporciona los nutrientes que las bacterias pueden utilizar antes o después de ser procesadas por el huésped. Varios estudios han demostrado la importancia de alimentar a los polluelos inmediatamente después de la eclosión, ya que ello aumenta su rendimiento productivo, los ayuda a crecer de manera eficiente y disminuye drásticamente la mortalidad [18; 19; 33].
De ello se desprende que, además de la administración inmediata de nutrientes esenciales para el crecimiento de los pollitos, una buena estrategia para asegurar el desarrollo de un sistema inmunológico eficiente es administrar probióticos que puedan contribuir a formar una población fundadora de bacterias comensales con la capacidad de excluir selectivamente las cepas patógenas, incluida C. perfringens [25; 39]. Los investigadores confirman que la exclusión competitiva producida por la inoculación de una microflora adulta en los pollitos de un día tiene un impacto positivo en la función intestinal y la resistencia a las enfermedades. Este enfoque permite dotar al pollito de un microbiota adulto completo, evitando así tener que añadir una o más cepas bacterianas a una microbiota ya formada [34; 35].
Conclusiones y perspectivas de futuro
La enteritis necrótica causada por la bacteria Clostridium perfringens es la causa de enormes pérdidas económicas en términos de rendimiento de producción en la industria avícola. Por lo tanto, se buscan alternativas rentables para remediar urgentemente los frecuentes brotes de EN en las manadas de pollos. Una combinación de medidas destinadas a evitar los factores predisponentes y combatir el patógeno parece ser la mejor estrategia para adoptar. Los probióticos pueden ser la mejor alternativa para reemplazar el uso de promotores de crecimiento antimicrobianos para aliviar la inflamación intestinal causada por C. perfringens. Muchos microorganismos han demostrado tener una actividad probiótica eficaz, incluidos los géneros Lactobacillus, Bacillus, Bifidobacterium y Enterococcus.
Se necesitan más estudios para definir el mecanismo de colonización de C. perfringens y para desarrollar nuevos probióticos que puedan reducir significativamente el uso de los antibióticos para impedir el crecimiento de bacterias patógenas en el huésped y así prevenir la aparición de la enteritis necrótica.
Referencias (se enviarán a quienes las soliciten)
SILVIA RIVA 1, TESA PANISELLO MONJO 1
1 Cealvet SLu, C/San José de la Montaña 50-B, 43500 Tortosa, Spain; [email protected]; [email protected]
Para saber más:
-. www.CEALVET.com : Investigación y desarrollo de nuevos productos para la industría avícola
ARTÍCULOS sobre salud intestinal en avicultura y alimentación temprana de los pollitos publicados por el equipo técnico de CEALVET:
NOTICIAS sobre CEALVET:
CEALVET, condecorada con el Premio Nacional de Investigación, Ciencia e Innovación Isaac Peral
CEALVET recibe el sello de pyme innovadora por sus proyectos en desarrollo
Puedes escribirnos a [email protected] o unirte a los 120.000 lectores/usuarios mensuales de los Media de la Real Escuela de Avicultura suscribiéndote gratis aquí al eNewsletter de Avicultura.COM o siguiéndonos en Linkedin, Twitter o Facebook.
[wbcr_php_snippet id="90268"]
